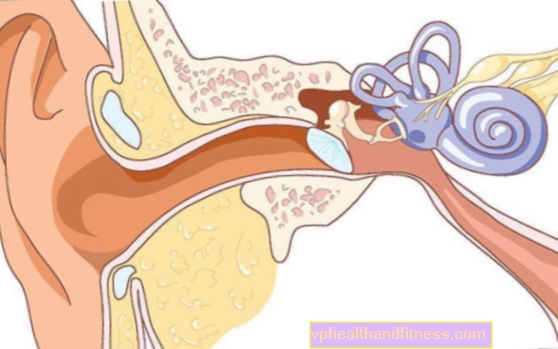
1 शीशी में 100 मिलीग्राम (160 मिलीग्राम) पाउडर होता है पुनर्गठन के लिए 5 मिलीलीटर (8 मिलीलीटर) ट्रैस्टुजुमाब इमाटासाइन के पुनर्गठन के बाद जलसेक के लिए 20 मिलीग्राम / एमएल की एकाग्रता पर केंद्रित होता है।
| नाम | पैकेज की सामग्री | सक्रिय पदार्थ | कीमत 100% | अंतिम बार संशोधित |
| Kadcyla | 1 शीशी, पाउडर तैयार करने के लिए अंतिम समाधान inf करने के लिए। | ट्रास्टुज़ुमाब एमटांसिन | 2019-04-05 |
कार्य
एंटीकैंसर दवा। Trastuzumab emtansine एक एंटीबॉडी-ड्रग संयुग्म है जिसमें trastuzumab, एक मानवकृत एंटी-HER2 IgG1 मोनोक्लोनल एंटीबॉडी, covalently एक स्थिर MCC थिओथर लिंक (4- [N-menididylylyl) द्वारा DM1 (maytansad derivative, microtubule inhibitor) से जुड़ा होता है। । Emtansine MCC-DM1 कॉम्प्लेक्स है। Trastuzumab के साथ DM1 के संयुग्मन से HER2 ओवरएक्सप्रेसिंग ट्यूमर कोशिकाओं के खिलाफ साइटोटोक्सिक दवाओं की चयनात्मक कार्रवाई का कारण बनता है, इस प्रकार सीधे DM1 की intracellular एकाग्रता में वृद्धि ट्यूमर कोशिकाओं में होती है। HER2 के लिए बाध्य होने पर, trastuzumab emtansine लाइसोसोमल गिरावट के बाद रिसेप्टर-मध्यस्थता आंतरिककरण है, DM1 युक्त catabolites (मुख्य रूप से lysine-MCC-DM1) को रिलीज़ करता है। Trastuzumab emtansine की कार्रवाई का तंत्र, trastuzumab और DM1 की गतिविधि द्वारा मध्यस्थता है। Trastuzumab emtansine, trastuzumab की तरह, रिसेप्टर के बाह्य डोमेन (ECD) के डोमेन IV से बांधता है, साथ ही साथ Fc domain रिसेप्टर्स और C1q को पूरक करता है। इसके अलावा, यह HER2 रिसेप्टर के ECD डोमेन की गतिविधि को रोकता है, phosphatidylinositol 3-kinase (PI3-K) पाथवे के सिग्नलिंग को रोकता है और मानव स्तन कैंसर कोशिकाओं में HER2 से अधिक एंटीऑक्सीडेंट डिपेंडेंट सेल्युलर बायोटॉक्सिसिटी (ADCC) मध्यस्थता करता है। DM1 ट्यूबिलिन से बांधता है। ट्यूबिलिन पोलीमराइजेशन को रोककर, DM1 और trastuzumab emtansine दोनों कोशिका चक्र के G2 / M चरण में गिरफ्तारी का कारण बनते हैं, जो अंततः एपोप्टोसिस द्वारा कोशिका मृत्यु का कारण बनता है। MCC लिंकर प्रणालीगत DM1 रिलीज़ को कम करता है और लक्ष्य साइट पर इसकी एकाग्रता बढ़ाता है। Trastuzumab emtansine deconjugated है और फिर सेल लाइसोसोम में प्रोटियोलिसिस द्वारा catabolized है। DM1 को मुख्य रूप से CYP3A4 द्वारा और CYP3A5 द्वारा कुछ हद तक मेटाबोलाइज किया जाता है। ट्रेस्टुजुमाब का T0.5 लगभग 4 दिन है। 3-सप्ताह के अंतराल पर दिए गए कई अंतःशिरा रोधगलन के बाद ट्रेस्टुजुमाब इमाटसाइन का कोई संचय नहीं था। Trastuzumab emtansine के फार्माकोकाइनेटिक्स पर आयु का कोई प्रभाव नहीं पड़ा।
मात्रा बनाने की विधि
नसों के द्वारा। तैयारी को एक चिकित्सक द्वारा निर्धारित किया जाना चाहिए और कैंसर रोगियों के उपचार में अनुभवी स्वास्थ्य पेशेवरों की देखरेख में प्रशासित किया जाना चाहिए। Trastuzumab emtansine प्राप्त करने वाले मरीजों को HER2 पॉजिटिव कैंसर - इम्यूनोहिस्टोकेमिस्ट्री (IHC) स्कोर 3+ या अनुपात )2 सीटू संकरण (ISH) पर होना चाहिए। सीई मार्किंग के साथ इन विट्रो डायग्नोस्टिक (आईवीडी) परीक्षणों का उपयोग करके टेस्ट किया जाना चाहिए। यदि सीई आईवीडी परीक्षण उपलब्ध नहीं है, तो परीक्षण को दूसरे वैध परीक्षण के साथ किया जाना चाहिए। चिकित्सा त्रुटियों से बचने के लिए शीशी लेबल की जांच करना महत्वपूर्ण है ताकि यह सुनिश्चित किया जा सके कि दवा तैयार की जा रही है और प्रशासित है कडिसीला (ट्रैस्टुज़ुमैब इमाटसाइन) और हर्सेप्टिन (ट्रैस्टुज़ुमैब) नहीं। अनुशंसित खुराक 3.6 मिलीग्राम / किग्रा शरीर का वजन है। प्रत्येक 3 सप्ताह (21-दिवसीय चक्र) को अंतःशिरा जलसेक के रूप में दिया जाता है। ट्यूमर के बढ़ने या अस्वीकार्य विषाक्तता की उपलब्धि तक मरीजों का इलाज किया जाना चाहिए। शुरुआती खुराक को 90 मिनट के अंतःशिरा जलसेक के रूप में प्रशासित किया जाना चाहिए। इंजेक्शन साइट पर बारीकी से नजर रखी जानी चाहिए क्योंकि प्रशासन के दौरान दवा उपचर्म में घुस सकती है। यदि पूर्व जलसेक को अच्छी तरह से सहन किया गया है, तो बाद की खुराक 30 मिनट के जलसेक के रूप में दी जा सकती है। रोगियों को जलसेक के दौरान और उसके बाद कम से कम 30 मिनट के लिए मनाया जाना चाहिए। यदि रोगी जलसेक से संबंधित लक्षण विकसित करता है, तो जलसेक दर धीमा या बाधित होना चाहिए। Trastuzumab emtansine को जानलेवा जलसेक प्रतिक्रियाओं के मामले में बंद किया जाना चाहिए। एलर्जी / एनाफिलेक्टिक जलसेक प्रतिक्रियाओं के साथ-साथ आपातकालीन उपकरणों के लिए दवाएं तत्काल उपयोग के लिए उपलब्ध होनी चाहिए। यदि एक नियोजित खुराक छूट जाती है, तो इसे जल्द से जल्द प्रशासित किया जाना चाहिए; अगले चक्र तक प्रतीक्षा न करें। 3 सप्ताह के अंतराल अंतराल को बनाए रखने के लिए खुराक अनुसूची को समायोजित किया जाना चाहिए। अगली खुराक को खुराक की सिफारिशों के अनुसार प्रशासित किया जाना चाहिए। रोगसूचक साइड इफेक्ट्स के प्रबंधन में चिकित्सा की समय-समय पर छूट, खुराक में कमी या उपचार छूट शामिल हो सकते हैं। खुराक में कमी का शेड्यूल (शुरुआती खुराक 3.6 मिलीग्राम / किग्रा): पहली खुराक में कमी 3 मिलीग्राम / किग्रा; दूसरी खुराक में कमी 2.4 mg / kg bw; यदि आगे खुराक में कमी की आवश्यकता होती है, तो उपचार रोक दिया जाना चाहिए। एएसटी और एएलटी उन्नयन के लिए खुराक संशोधन दिशानिर्देश: ग्रेड 2 (> 2.5 से N5 x ULN) - कोई खुराक समायोजन आवश्यक नहीं; ग्रेड 3 (> 5 से x20 x ULN) - तैयारी का उपयोग करें यदि AST / ALT ग्रेड to 2 (> 2.5 से 20 x ULN) तक कम हो जाए - उपचार बंद कर दें। हाइपरबिलिरुबिनमिया के लिए खुराक में संशोधन के नियम: ग्रेड 2 (> 1.5 से UL3 x ULN) - तैयारी का उपयोग तब करें जब बिलीरुबिन का स्तर घटकर ग्रेड for1 हो जाए। (> ULN से 1.5 x ULN), कोई खुराक समायोजन आवश्यक नहीं; ग्रेड 3 (> 3 से x10 x ULN) - तैयारी का उपयोग करें यदि बिलीरुबिन एकाग्रता ग्रेड N 1 (> ULN से 1.5 x ULN) तक घट जाती है, तो खुराक कम करें (खुराक में कमी अनुसूची देखें); ग्रेड 4 (> 10 x ULN) - उपचार बंद करें। थ्रोम्बोसाइटोपेनिया के लिए खुराक संशोधन नियम: ग्रेड 3 (प्लेटलेट एकाग्रता 25,000 से 3) - प्लेटलेट एकाग्रता ≤1 होने पर तैयारी का उपयोग करें। (जैसे, ,00075,000 / मिमी 3); कोई खुराक समायोजन आवश्यक नहीं; ग्रेड 4 (प्लेटलेट एकाग्रता 3) - प्लेटलेट एकाग्रता .1 तक पहुंचने पर तैयारी का उपयोग करें। (उदा। ,00075,000 / mm3) फिर खुराक कम करें (खुराक में कमी अनुसूची देखें)। वेंट्रिकुलर डिसफंक्शन के रोगियों में खुराक संशोधन सिद्धांत: LVEF 45% - चिकित्सा जारी रखें; एलवीईएफ 40% से %45% तक एक साथ इजेक्शन अंश की कमी के साथ - तैयारी का उपयोग न करें; 3 सप्ताह के भीतर एलवीईएफ पर फिर से भरोसा करें, अगर एलवीईएफ बेसलाइन से points10 प्रतिशत अंक है, तो उपचार बंद कर दें; रोगसूचक CHF - उपचार रोकें। बच्चे और किशोर: 18 वर्ष से कम उम्र के बच्चों और किशोरों में सुरक्षा और प्रभावकारिता स्थापित नहीं की गई है क्योंकि इस आबादी में स्तन कैंसर (एमबीसी) ज्ञात नहीं है। रोगियों के विशेष समूह। थेरेपी को अस्थायी रूप से उन रोगियों में बाधित किया जाना चाहिए जो ग्रेड ne2 तक पहुंचने तक ग्रेड 3 या 4 परिधीय न्यूरोपैथी विकसित करते हैं; जब उपचार फिर से शुरू होता है, तो खुराक को कम करने के लिए विचार दिया जा सकता है जैसा कि खुराक में कमी अनुसूची में बताया गया है। 65 वर्ष की आयु के रोगियों के लिए कोई खुराक समायोजन की आवश्यकता नहीं है; years75 वर्ष के रोगियों में चिकित्सा की सुरक्षा और प्रभावकारिता निर्धारित करने के लिए अपर्याप्त डेटा हैं। हल्के या मध्यम गुर्दे की हानि वाले रोगियों में कोई प्रारंभिक खुराक समायोजन की आवश्यकता नहीं होती है; गंभीर गुर्दे की कमी वाले रोगियों में खुराक समायोजन की संभावित आवश्यकता निर्धारित नहीं की जा सकती है और इसलिए इन रोगियों की सावधानीपूर्वक निगरानी की जानी चाहिए। हल्के या मध्यम यकृत हानि वाले रोगियों में कोई प्रारंभिक खुराक समायोजन की आवश्यकता नहीं होती है। Trastuzumab emtansine गंभीर यकृत हानि वाले रोगियों में अध्ययन नहीं किया गया है; उपचार के दौरान ज्ञात हेपेटोटॉक्सिसिटी के कारण यकृत हानि के साथ रोगियों का इलाज करते समय सावधानी बरती जानी चाहिए। देने का तरीका। तैयारी को भंग कर दिया जाना चाहिए और चिकित्सा कर्मियों द्वारा पतला किया जाना चाहिए और अंतःशिरा जलसेक के रूप में प्रशासित किया जाना चाहिए। इसे बोलस या रैपिड इंजेक्शन के रूप में नहीं दिया जाना चाहिए।
संकेत
HER2 पॉजिटिव, अक्षम स्थानीय स्तर पर उन्नत या मेटास्टैटिक स्तन कैंसर के साथ वयस्क रोगियों की मोनोथेरेपी, पहले ट्रास्टुज़्माब और एक टैक्सेन के साथ संयोजन में या अलग से इलाज किया जाता है। जिन रोगियों ने पहले स्थानीय रूप से उन्नत या सामान्यीकृत बीमारी के लिए उपचार किया है, या जो सहायक चिकित्सा को पूरा करने के 6 महीने के भीतर या उसके बाद समाप्त हो गए हैं।
मतभेद
सक्रिय पदार्थ या तैयारी के अन्य अवयवों के लिए अतिसंवेदनशीलता।
एहतियात
निमोनिया सहित इंटरस्टीशियल लंग डिजीज (ILD) के मामले, ट्रेस्टुजुमाब इत्मेन्सिन के साथ नैदानिक परीक्षणों में सूचित किए गए हैं; कुछ तीव्र श्वसन विफलता से जुड़े हैं या घातक रहे हैं। ILD या निमोनिया के निदान वाले रोगियों में तैयारी के साथ उपचार बंद करने की सिफारिश की जाती है। आराम से डिस्पेनिया के साथ रोगियों, उन्नत कैंसर की जटिलताओं और संबंधित रोगों के साथ फुफ्फुसीय जटिलताओं के विकास का खतरा बढ़ सकता है। तैयारी के साथ उपचार के दौरान, यकृत और पित्त पथ के गंभीर विकार, जिगर के गांठदार पुनर्योजी अतिवृद्धि (एनआरएच) सहित और दवा-प्रेरित जिगर की चोट के कारण मौतें देखी गईं; कोमपोटॉक्सिक और / या सहवर्ती दवाओं के बारे में जिन्हें हेपेटोटॉक्सिक क्षमता ज्ञात है, वे भी प्रभावित हो सकती हैं। उपचार शुरू करने से पहले और बाद में खुराक से पहले जिगर समारोह की निगरानी की जानी चाहिए। बेसलाइन एएलटी ऊंचाई वाले मरीजों (जैसे यकृत मेटास्टेस से जुड़े), यकृत की विफलता के विकास के लिए अनुमानित हैं और ग्रेड 3-5 यकृत विषाक्तता या ऊंचा यकृत प्रयोगशाला स्तरों के उच्च जोखिम में हैं। एनआरएच के मामलों का निदान यकृत बायोप्सी द्वारा किया गया। NRH की घटना को सभी रोगियों में पोर्टल हाइपरटेंशन और / या लिवर सीटी स्कैन पर देखी जाने वाली सिरोसिस जैसी छवि के नैदानिक लक्षणों के साथ माना जाना चाहिए, लेकिन सामान्य सीरम ट्रांसअमाइनेज स्तर और सिरोसिस के कोई अन्य सबूत नहीं हैं। यदि एनआरएच का निदान किया जाता है, तो तैयारी के साथ उपचार बंद कर दिया जाना चाहिए। यह उपचार दीक्षा से पहले सीरम ट्रांसएमिनेस> 2.5 x ULN (सामान्य की ऊपरी सीमा) या कुल बिलीरुबिन> 1.5 x ULN के साथ रोगियों में अध्ययन नहीं किया गया है। सीरम ट्रांसएमिनेस गतिविधि> 3 एक्स ULN और एक साथ कुल बिलीरुबिन एकाग्रता> 2 एक्स ULN के मामले में, उपचार समाप्त किया जाना चाहिए। यकृत की दुर्बलता वाले रोगियों के उपचार में सावधानी बरती जानी चाहिए। उपचार के दौरान बाएं वेंट्रिकुलर शिथिलता का खतरा बढ़ जाता है। Trastuzumab emtansine के साथ इलाज किए गए रोगियों में, बाएं वेंट्रिकुलर इजेक्शन अंश (LVEF) में 50 साल की कमी देखी गई, जिसमें प्रारंभिक कम LVEF मूल्य (25 किग्रा / एम 2) है। मानक कार्डियक फ़ंक्शन परीक्षण (इकोकार्डियोग्राम या मल्टी-गेटेड रेडियोसोटोप एंजियोग्राफी) उपचार की दीक्षा से पहले और नियमित अंतराल पर (जैसे हर 3 महीने में) किया जाना चाहिए। अधिकांश नैदानिक परीक्षणों में बेसलाइन पर मरीजों का LVEF '50% था। हृदय की विफलता, गंभीर अतालता वाले उपचार की आवश्यकता वाले रोगियों, रैंडमाइजेशन से पहले 6 महीने के भीतर मायोकार्डियल रोधगलन या अस्थिर एनजाइना का इतिहास, या उन्नत कैंसर के कारण बेचैनी के साथ, अध्ययन से बाहर रखा गया था। बाएं वेंट्रिकुलर विकारों की स्थिति में, अगली खुराक के प्रशासन को स्थगित कर दिया जाना चाहिए या चिकित्सा को समाप्त कर दिया जाना चाहिए। एक infusion से संबंधित प्रतिक्रिया के कारण trastuzumab उपचार को बंद करने वाले रोगियों में ट्रास्टुज़ुमैब ईमटासाइन उपचार के प्रभाव का अध्ययन नहीं किया गया है; इस रोगी समूह में इस दवा के साथ चिकित्सा की सिफारिश नहीं की जाती है। थेरेपी उन रोगियों में बंद कर दी जानी चाहिए जो लक्षणों के समाधान तक एक गंभीर जलसेक-संबंधी प्रतिक्रिया विकसित करते हैं। चिकित्सा की पुन: दीक्षा को प्रतिक्रिया की गंभीरता के नैदानिक निर्णय पर आधारित माना जाना चाहिए। जीवन-धमकी वाले जलसेक प्रतिक्रिया की स्थिति में उपचार बंद कर दिया जाना चाहिए। अतिसंवेदनशीलता के कारण ट्रैस्टुजुमाब से बंद रोगियों में ट्रास्टुज़ुमैब इमाटीनिन उपचार के प्रभाव का अध्ययन नहीं किया गया है; इन रोगियों में ट्रेस्टुजुमाब इमाटसाइन के उपयोग की सिफारिश नहीं की जाती है। मरीजों को अतिसंवेदनशीलता / एलर्जी प्रतिक्रियाओं के लिए निगरानी की जानी चाहिए, लक्षण जलसेक संबंधी प्रतिक्रियाओं के समान हो सकते हैं; गंभीर एनाफिलेक्टिक प्रतिक्रियाओं को देखा गया है। यदि अतिसंवेदनशीलता (बाद के उल्लंघन के दौरान बढ़ी हुई प्रतिक्रियाओं के साथ) होती है, तो ट्रास्टुज़ुमैब इमाटसाइन के साथ उपचार बंद कर दिया जाना चाहिए।रक्तस्रावी घटनाओं (सीएनएस, श्वसन और जठरांत्र संबंधी रक्तस्राव सहित) के जोखिम के कारण, सावधानी बरतनी चाहिए और एंटीकोआगुलंट्स या एंटीप्लेटलेट एजेंटों के साथ सह-प्रशासित होने पर अतिरिक्त निगरानी पर विचार किया जाना चाहिए। यह सिफारिश की जाती है कि प्लेटलेट काउंट्स को ट्रैस्टुजुमाब इमाटसाइन की प्रत्येक खुराक से पहले मॉनिटर किया जाए। थ्रोम्बोसाइटोपेनिया (/100,000 / mm3) वाले रोगियों और एंटीकोआगुलेंट थेरेपी प्राप्त करने वाले रोगियों (जैसे वारफारिन, हेपरिन, कम आणविक भार हेपरिन) को ट्रैस्टुजुमाब इमाटसाइन के साथ उपचार के दौरान बारीकी से देखा जाना चाहिए। Trastuzumab emtansine प्लेटलेट काउंट um100,000 / mm3 के साथ रोगियों में चिकित्सा की दीक्षा से पहले अध्ययन नहीं किया गया है। थ्रोम्बोसाइटोपेनिया के ग्रेड 3 या उससे अधिक (3) तक बिगड़ने की स्थिति में, तैयारी का उपयोग तब तक नहीं किया जाना चाहिए जब तक कि विषाक्तता ग्रेड 1 (,00075,000 / mm3) तक कम न हो जाए। Trastuzumab emtansine के साथ नैदानिक परीक्षणों में, ग्रेड 1 परिधीय न्यूरोपैथी, मुख्य रूप से संवेदी, हुई है। नैदानिक परीक्षण में भागीदारी से ग्रेड peripher3 परिधीय न्यूरोपैथी वाले मरीजों को बाहर रखा गया था। ग्रेड peripher2 में जटिलता कम होने तक ग्रेड 3 या 4 परिधीय न्यूरोपैथी वाले रोगियों का उपचार समय-समय पर बाधित होना चाहिए। न्यूरोटॉक्सिसिटी के संकेतों के लिए मरीजों की नियमित रूप से निगरानी की जानी चाहिए। जैविक तैयारियों की ट्रेसबिलिटी में सुधार करने के लिए, रोगी फ़ाइल में प्रशासित दवा का व्यापार नाम स्पष्ट रूप से (या कहा गया) लिखा होना चाहिए। 18 वर्ष से कम उम्र के बच्चों और किशोरों में दवा की सुरक्षा और प्रभावकारिता स्थापित नहीं की गई है क्योंकि इस आबादी में प्रसार स्तन कैंसर नहीं पाया जाता है। इसे बोलस या रैपिड इंजेक्शन के रूप में नहीं दिया जाना चाहिए।
अवांछनीय गतिविधि
बहुत आम: मूत्र पथ के संक्रमण, थ्रोम्बोसाइटोपेनिया, एनीमिया, हाइपोकैलेमिया, अनिद्रा, परिधीय न्यूरोपैथी, सिरदर्द, रक्तस्राव, एपिस्टेक्सिस, खांसी, डिस्पेनिया, स्टामाटाइटिस, दस्त, उल्टी, मतली, कब्ज, शुष्क मुंह, पेट दर्द , लाल चकत्ते, मस्कुलोस्केलेटल दर्द, आर्थ्राल्जिया, माइलियागिया, थकान, बुखार, अस्थानिया, ठंड लगना, संक्रमण में वृद्धि। आम: न्युट्रोपेनिया, ल्यूकोपेनिया, अतिसंवेदनशीलता, चक्कर आना, अपच, स्मृति दुर्बलता, ड्राई आई सिंड्रोम, नेत्रश्लेष्मलाशोथ, दृश्य गड़बड़ी, लैक्रिमेशन में वृद्धि, बाएं निलय में शिथिलता, उच्च रक्तचाप, अपच, मसूड़ों से खून आना, त्वचा का पक्षाघात, खालित्य, नाखून रोग , पामर-प्लांटर इरिथ्रोडायस्थेसिया, पित्ती, परिधीय शोफ, क्षारीय फॉस्फेट में वृद्धि, जलसेक से संबंधित प्रतिक्रियाएं (त्वचा की लालिमा, ठंड लगना, बुखार, पेचिश, निम्न रक्तचाप, घरघराहट, ब्रोन्कोस्पास्म, टैचीकार्डिया)। असामान्य: निमोनिया (ILD), हेपेटोटॉक्सिसिटी, यकृत विफलता, गांठदार पुनर्योजी अतिवृद्धि, पोर्टल उच्च रक्तचाप, इंजेक्शन साइट अतिरिक्तता (एरिथेमा, कोमलता, त्वचा की जलन, दर्द या सूजन)। इसके अलावा, हाइपरबिलिरुबिनमिया देखा गया है। क्लिनिकल परीक्षण में, सीरम ट्रांसएमिनेस (ग्रेड 1-4) में ऊँचाई ट्रेस्टुज़ुमैब इमाटसाइन के साथ उपचार के दौरान हुई और आमतौर पर क्षणिक थी। खुराक के बाद 8 वें दिन चरमोत्कर्ष पर ट्रांसमिनिसिस की ऊंचाई सबसे अधिक बार क्षणिक थी। इसके बाद, विषाक्तता घटकर ग्रेड 1 हो गई या अगले चक्र से पहले हल हो गई। एक संचयी प्रभाव भी था (बाद के चक्रों के साथ ग्रेड 1-2 एएलटी / एएसटी उत्थान के साथ रोगियों का प्रतिशत)। ऊंचे ट्रांसएमिनेस के स्तर वाले रोगियों में, अधिकांश रोगियों को ट्रैस्टुज़ुमैब एमटैन्सिन की अंतिम खुराक के 30 दिनों के भीतर ग्रेड 1 विषाक्तता में कमी या पुनर्प्राप्ति का अनुभव हुआ। नैदानिक परीक्षणों में भाग लेने वाले 2.2% रोगियों में बाएं वेंट्रिकुलर शिथिलता पाई गई। ज्यादातर मामलों में, ग्रेड 1 या 2 LVEF की कमी स्पर्शोन्मुख थी। 0.4% रोगियों में ग्रेड 3 या 4 विषाक्तता देखी गई थी, आमतौर पर उपचार के प्रारंभिक चक्र (1-2) के दौरान। गंभीर (ग्रेड )3) रक्तस्रावी घटनाओं को सभी रोगियों में से 2.2% में बताया गया। थ्रोम्बोसाइटोपेनिया नैदानिक परीक्षणों में 24.9% रोगियों में हुआ और चिकित्सा के बंद होने के लिए सबसे आम प्रतिकूल प्रतिक्रिया थी। नैदानिक परीक्षणों में, एशियाई रोगियों में थ्रोम्बोसाइटोपेनिया की घटना और गंभीरता अधिक थी। इन जटिलताओं को विकसित करने वाले कुछ रोगियों को थक्का-रोधी चिकित्सा से भी उपचारित किया गया। घातक रक्तस्राव के एपिसोड और गंभीर रक्तस्राव की जटिलताएं थीं, जिसमें सीएनएस रक्तस्राव 5.3% रोगियों में एंटी-ट्रस्टुज़ुमैब एमटैन्सिन एंटीबॉडी के लिए सकारात्मक परीक्षण किया गया था।
गर्भावस्था और दुद्ध निकालना
गर्भवती महिलाओं में ट्रेस्टुजुमाब इमाटसाइन के उपयोग की सिफारिश नहीं की जाती है। गर्भावस्था से पहले, महिलाओं को भ्रूण को नुकसान की संभावना के बारे में सूचित किया जाना चाहिए। हालांकि, जो मरीज गर्भवती हो जाते हैं, उन्हें तुरंत डॉक्टर से संपर्क करना चाहिए। यदि एक गर्भवती महिला को ट्रास्टुज़ुमैब एमटैन्सिन के साथ इलाज किया जाता है, तो एक बहु-विषयक टीम द्वारा निकट निगरानी की सिफारिश की जाती है। Trastuzumab एक गर्भवती महिला को प्रशासित होने पर भ्रूण को नुकसान या मृत्यु का कारण बन सकता है। तैयारी के साथ इलाज किए गए गर्भवती महिलाओं के बच्चों में, ऑलिगोहाइड्रामनिओस के मामले, उनमें से कुछ घातक फेफड़ों के हाइपोप्लेसिया के लिए अग्रणी होते हैं। DM1, ट्रेस्टुज़ुमैब इमाटसाइन के साइटोटॉक्सिक घटक, टेराटोजेनिक और संभावित भ्रूणोटॉक्सिक हो सकते हैं। महिलाओं को ट्रैस्टुजुमाब इमाटासिन थेरेपी शुरू करने से पहले स्तनपान कराना बंद कर देना चाहिए। उपचार रोकने के 7 महीने बाद मरीज स्तनपान शुरू कर सकते हैं। प्रसव की क्षमता वाली महिलाओं को दवा के साथ उपचार के दौरान प्रभावी गर्भनिरोधक का उपयोग करना चाहिए और 7 महीने तक ट्रास्टुज़ुमैब एमटैन्सिन की अंतिम खुराक के बाद। गर्भनिरोधक के प्रभावी तरीकों का उपयोग पुरुषों या उनकी महिला भागीदारों द्वारा भी किया जाना चाहिए।
टिप्पणियाँ
जब तक इन लक्षणों को हल नहीं किया जाता है, तब तक जलसेक-संबंधी प्रतिक्रियाओं का सामना करने वाले मरीजों को मशीनों को ड्राइव या उपयोग नहीं करना चाहिए। के आधार पर तैयार की गई जानकारी के एस.पी.सी. 13 जुलाई, 2017 वर्तमान SmPC www.roche.pl पर उपलब्ध है।
सहभागिता
मानव यकृत के माइक्रोसोम में चयापचय अध्ययन के इन विट्रो परिणामों से संकेत मिलता है कि DM1 मुख्य रूप से एंजाइम CYP3A4 द्वारा और CYP3A5 द्वारा कुछ हद तक चयापचय होता है। CYP3A4 (जैसे ketoconazole, itraconazole, clearithromycin, atazanavir, indinavir, nefazodone, nelfinavir, ritonavir, saquinavir, telithromycin और voriconazole) के मजबूत अवरोधकों के सहवर्ती उपयोग से डीएम के रूप में इस वृद्धि से बचा जा सकता है। एक वैकल्पिक सूत्रीकरण जो CYP3A4 को थोड़ा या केवल बाधित नहीं करता है, पर विचार किया जाना चाहिए। यदि मजबूत CYP3A4 अवरोधकों के सहवर्ती उपयोग को टाला नहीं जा सकता है, और जहां संभव हो, Trastuzumab emtansine के विलंबित प्रशासन पर विचार करें जब तक CYP3A4 अवरोधकों को संचलन (लगभग 3 अवरोधकों के अर्ध-जीवन) से साफ नहीं किया जाता है। हालांकि, यदि एक मजबूत CYP3A4 अवरोधक का उपयोग सहवर्ती रूप से किया जाता है, और ट्रास्टुज़ुमैब एमटैनसिन के साथ उपचार में देरी नहीं की जा सकती है, तो ऐसे मामलों में प्रतिकूल प्रभावों के लिए रोगी को बारीकी से निगरानी की जानी चाहिए।
तैयारी में पदार्थ शामिल हैं: ट्रास्टुज़ुमैब एमटैनसीन
प्रतिपूर्ति की दवा: नहीं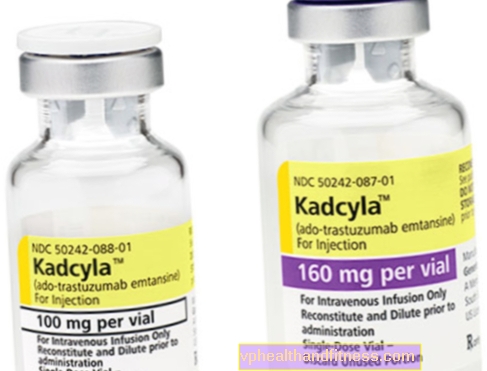










--objawy-przyczyny-zapobieganie.jpg)